こんにちは、risaxhicaです。
今年は、曜日と祝日のつながりが恵まれてて、年末の休みが長いですね。
カレンダー通りに休むと9連休でしょうか?すごいですね…!
もちろん、PVは短期のタイムラインによる報告業務を行っていることから毎年カレンダー通りに休むのは難しいですし(休日出勤してカバーする必要がある)
その前にできるだけ業務を片付けて休みを乗りきれるように準備するので、今追い込みに入ってる感があります。。。
でもこんな機会もめったにないので!
年末は久々に時間があるので、プレゼンスキルを高めるための方法論やtipsを調べること、自分周りの環境を今できるAI導入でグレードアップするために、最新サービスをpickしておくことをやっておきたいです。
Blogでももっとできることをいろいろ考えていきたいなあと思ってます!
それでは、今日は製薬業界におけるリスクマネジメントを書いていきたいと思います。
リスクマネジメントとは?
製薬業界におけるリスクマネジメントとは、リスク評価、リスク最小化策、副作用監視体制などを含みます。
医薬品の安全性の確保を図るためには、開発の段階から市販後に至るまで常にリスクを適正に管理する方策を検討することが重要です。医薬品リスク管理計画(以下、RMP)は、医薬品の開発から市販後まで一貫したリスク管理をひとつの文書に分かり易くまとめ、調査・試験やリスクを低減するための取り組みの進捗に合わせて、または、定期的に確実に評価が行われるようにするものです。また、RMPを公表して、医療関係者の皆様と市販後のリスク管理の内容を広く共有することで、市販後の安全対策の一層の充実強化が図られることが期待されます。
WHOで定められたPVの定義の prevention of adverse effect or any other medicine/vaccine related problemにあたる、PV activities の action の部分です。
What is Pharmacovigilance?
Medicines and vaccines have transformed the prevention and treatment of diseases. In addition to their benefits, medicinal products may also have side effects, some of which may be undesirable and / or unexpected. Pharmacovigilance is the science and activities relating to the detection, assessment, understanding and prevention of adverse effects or any other medicine/vaccine related problem. .
医薬品リスク管理計画(RMP)とは
PMDA (医薬品医療機器総合機構)医薬品リスク管理計画(RMP)と言われ、RMPには、リスク評価、リスク最小化計画、副作用監視体制などが記載されています。
RMPの概要については、PMDAのHPに分かりやすく記載してありますし、下記の図に要約されています。
医薬品リスク管理計画(RMP:Risk Management Plan) | 独立行政法人 医薬品医療機器総合機構
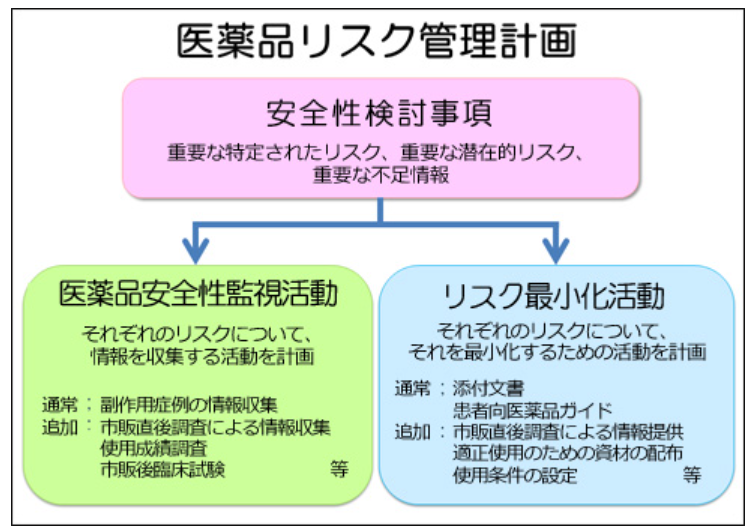
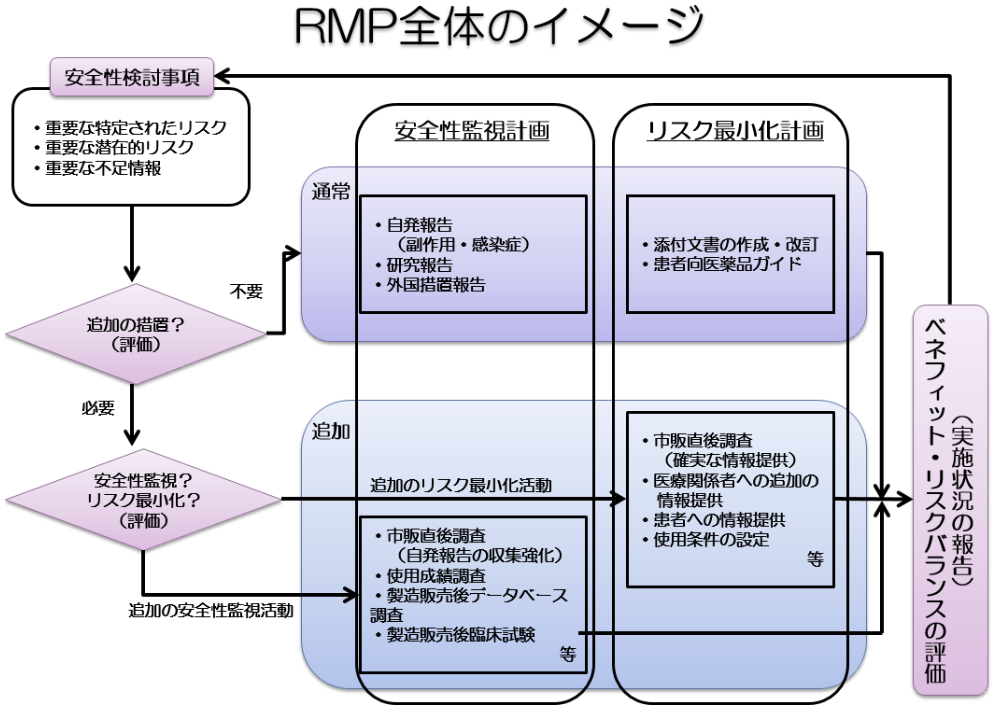
「医薬品リスク管理計画 (RMP: Risk Management Plan)」(PMDA HP記載)
薬剤ごとに提出されたRMPについては、PMDAのHPにて確認することができます。

「医薬品リスク管理計画 (RMP: Risk Management Plan)」(PMDA HP記載)
RMPの内容を見てみよう
では、具体的な中身について、具体的にファイザー株式会社がMAHである、「アトガム点滴静注」について見ていきたいと思います。
アトガム点滴静注液 250mgに係る医薬品リスク管理計画書(RMP)の概要672212_6399413A2021_003RMP.pdf
別紙様式2にて、RMPのサマリーを記載されたテーブルが配置されています。
記載内容は、安全性検討事項、医薬品安全性監視活動、リスク最小化活動等です。
安全性検討事項(Safety Specification: SS)は、更に下記の3つに分類されます。
- 重要な特定されたリスク (identified risk)
- 重要な潜在的リスク (potential risk)
- 重要な不足情報 (missing information) ex: 妊娠・授乳婦、小児への影響、適応外使用時の安全性等
治験で少数のコホートで発生が確認できないまれな副作用、遅発性の副作用、またへ併存疾患を持つ患者への影響等は治験実施時に検出できない情報で治験における検証の限界になります。
では、実際の別紙様式2です。
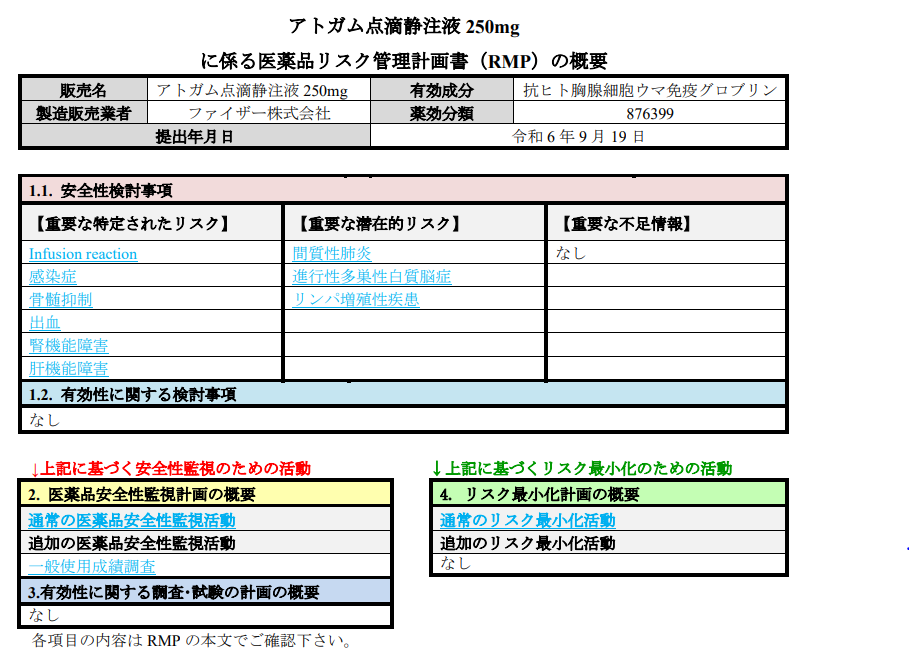
別紙様式1にて、その内容についてまずは概要と、さらに詳細に記載されています。
品目の概要記載項目
- 承認年月日
- 薬効分類
- 承認番号
- 再審査期間
- 国際誕生日(DIBD)
- 販売名
- 有効成分
- 含量及び剤型
- 用法及び用量
- 効能又は効果
- 承認条件
- 備考
重要な特定されたリスクとして、Infusion reaction、感染症、骨髄抑制、出血、腎機能障害、肝機能障害、間質性肺炎、進行性多巣性白質脳症、リンパ増殖性疾患等があり、それらについてそれぞれ、重要な潜在的リスクとした理由、医薬品安全性監視活動の内容(一般使用成調査、全例調査等)リスク最小化活動の内容が記載されています。

PMDA HP アトガム点滴静注液 250mgに係る医薬品リスク管理計画書(RMP)より
ICHガイドラインについて
3極の1つとして、日本は基本的にICH(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use(医薬品規制調和国際会議))ガイドラインに従い、医薬品安全性監視活動を行います。
ICH E2E Pharmacovigilance Guideline では、リスク評価の方法や、リスク最小化戦略としてどのような施策を取るべきかが明文化されており、各国での実施においてこれを基に運用がなされています。
特に、リスクマネジメントに関する重要なガイドラインは次の通りです:
- E2E Pharmacovigilance (E2E PV)
薬剤の安全性評価に関する基本的な枠組みを提供。副作用の監視や報告、リスク評価を行う。 - E2E Risk Management(リスクマネジメントの実施ガイドライン)
医薬品のリスク評価と管理戦略(リスク・ベネフィット分析)を明確にするガイドライン。 - ICH E2E Pharmacovigilance Guideline
リスク評価の方法や、リスク最小化戦略としてどのような施策を取るべきかが明文化されており、各国での実施においてこれを基に運用がなされている。
ただ日本は欧米で2000年初期よりリスク管理計画が導入されていたのに比べ、リスク管理計画の導入が遅れ、2013年頃からようやく積極的に導入されてきています。
現場でのRMP利活用の取り組み
現場での使用についても、PMDAのHPに解説動画がありました。
ただ、この動画を見ると、RMPについては更新があっても各薬局に通知があるわけでなく、扱う薬剤をリスト化する労力を各薬局で行わなくてはいけないようです(・□・;)
ファイルをtransferして管理するシステムはあるようですが、そこは自動で更新されないので、
情報を取りにいき、チェックしていくというアクションが必要です。
(Excelということも言っていて驚きました。確かにExcelの方がシステム導入よりコストがかからないケースは多々あるので分かりますが、医療の現場でそのような統一システムの導入が少ないのは問題ですね)
おわりに
PVの活動は本当に多岐にわたるので、他部署やPMDAとのやり取りになり、患者の方の実際を感じられる機会が本当に少ないです。
こうやってRMPが現場に提供され、患者の方に役立っているのだなと思うと、モチベーションにつながりそうです。
それから医療の現場との連携がもっとシームレスに行えるよう、システム構築を見据えて進めていかないといけないなと思いました。
そこについて、現在の日本のDBとその活用状況について、もう少し調べてみたいと思いました。
(何か有益な情報があったらまたシェアしたいと思います!)
ではまた。



コメント